Axit sulfuric (H₂SO₄) là một trong những hóa chất công nghiệp quan trọng nhất hiện nay, được áp dụng rộng rãi trong nhiều lĩnh vực như sản xuất phân bón, chế tạo pin, luyện kim, xử lý nước thải và hàng loạt quy trình công nghiệp khác. Với tính ăn mòn và tính háo nước đặc trưng, H₂SO₄ đòi hỏi quy trình bảo quản và sử dụng an toàn nghiêm ngặt. Trong bài viết này, Hóa Chất Lộc Thiên sẽ cung cấp cho bạn cái nhìn toàn diện về công thức cấu tạo của h2so4 (axit sulfuric), phân tử khối,tính chất hóa học cũng như cách ứng dụng và hướng dẫn an toàn khi làm việc với axit sulfuric.
Công Thức Cấu Tạo Của H2SO4
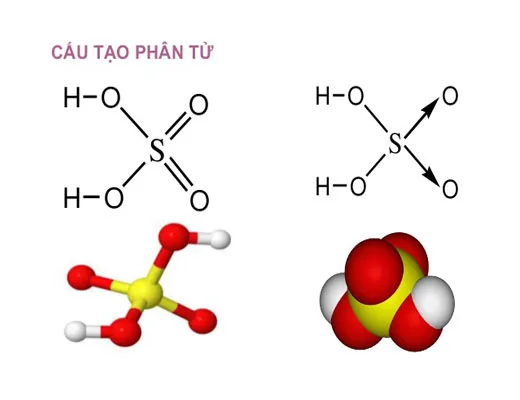
Công thức phân tử:H₂SO₄Công thức cấu tạo của H₂SO₄ cho thấy rằng
- Lưu huỳnh (S) nằm ở trung tâm phân tử.
- Hai nguyên tử oxy (O) liên kết đôi với lưu huỳnh, giúp ổn định cấu trúc.
- Hai nguyên tử oxy còn lại liên kết đơn với lưu huỳnh và mỗi nguyên tử này liên kết với một nguyên tử hydro (H), tạo thành nhóm hydroxyl (-OH).
Kết luận: Công thức cấu tạo H₂SO₄ giúp nó trở thành một axit vô cơ mạnh, dễ dàng phản ứng với nước, kim loại, bazơ và các hợp chất hữu cơ.
Nguyên Tử Khối, Phân Tử Khối & Khối Lượng Phân Tử H₂SO₄
Nguyên tử khối của các nguyên tố trong H₂SO₄Thành phần nguyên tử & nguyên tử khối:
- Hydro (H): 1.008 g/mol
- Lưu huỳnh (S): 32.065 g/mol
- Oxy (O): 16.00 g/mol
Phân tử khối của H₂SO₄: M(H₂SO₄) = (2 × 1.008) + (1 × 32.065) + (4 × 16.00) = 98.08 g/molM của H₂SO₄ hay còn gọi là phân tử khối H₂SO₄ có giá trị:
- Tính toán lượng axit cần thiết trong các phản ứng hóa học.
- Cân bằng phương trình phản ứng trong công nghiệp sản xuất.
- Xác định nồng độ axit trong xử lý hóa chất & môi trường.
- M của H₂SO₄ là 98.08 g/mol, một con số quan trọng trong ngành công nghiệp hóa chất.
Ứng dụng thực tế: Nhờ vào phân tử khối chuẩn xác, H₂SO₄ được kiểm soát chặt chẽ trong các quy trình sản xuất và phân tích hóa học.
Tính Chất Vật Lý & Hóa Học Của H₂SO₄
Tính chất vật lý
- Trạng thái: Chất lỏng sánh, không màu đến hơi vàng nhạt.
- Tỷ trọng: 1.84 g/cm³ (H₂SO₄ đậm đặc).
- Điểm sôi: 337°C (không dễ bay hơi).
- Điểm nóng chảy: 10.37°C.
- Tính hòa tan: Tan mạnh trong nước, sinh nhiệt cao.
Tính chất hóa học
- Tính axit mạnh: H₂SO₄ phân ly mạnh trong nước tạo ion H⁺, có khả năng phản ứng với nhiều kim loại và bazơ.
- H₂SO₄ → 2H⁺ + SO₄²⁻
- Tính oxi hóa mạnh: H₂SO₄ đặc có thể oxi hóa nhiều kim loại như Cu, Zn, Fe…
- Tính háo nước: Có thể gây bỏng nặng khi tiếp xúc với cơ thể.
Lưu ý quan trọng: Luôn pha loãng H₂SO₄ bằng cách rót từ từ axit vào nước, không làm ngược lại để tránh phản ứng tỏa nhiệt mạnh gây nguy hiểm.

Ứng Dụng Của H₂SO₄ Trong Công Nghiệp
Ngành sản xuất phân bón
Axit sulfuric là nguyên liệu cốt lõi trong sản xuất phân bón, chiếm khoảng 60% tổng sản lượng H₂SO₄ trên toàn cầu. Đây là chất xúc tác quan trọng trong quá trình sản xuất phân super lân (Ca(H₂PO₄)₂) và các loại phân lân khác.
Vai trò của H₂SO₄ trong sản xuất phân bón:
- Phân hủy quặng photphat thành axit photphoric (H₃PO₄) – tiền chất quan trọng của phân lân.
- Tăng hiệu suất hấp thụ dưỡng chất của cây trồng nhờ cải thiện tính tan của phân bón.
- Ứng dụng trong phân ure và amoni sulfat, giúp ổn định nitơ và nâng cao hiệu suất phân bón.
Tác động trong ngành nông nghiệp: Nhờ có H₂SO₄, sản xuất phân bón hiệu quả hơn, nâng cao năng suất cây trồng, đáp ứng nhu cầu thực phẩm toàn cầu.

Chế tạo pin axit chì
H₂SO₄ là thành phần chất điện phân chính trong các loại ắc quy axit-chì được sử dụng rộng rãi trong ô tô, xe máy, hệ thống UPS và pin công nghiệp.Tác dụng quan trọng của H₂SO₄ trong pin axit chì:
- Tham gia vào phản ứng điện hóa tạo ra dòng điện trong ắc quy.
- Ổn định điện áp, đảm bảo tuổi thọ pin lâu dài nhờ tính ổn định hóa học.
- Tăng hiệu suất sạc/xả, duy trì năng lượng bền vững trong các hệ thống lưu trữ điện.
Ứng dụng thực tiễn: H₂SO₄ giúp duy trì hoạt động ổn định của xe cộ, thiết bị công nghiệp, hệ thống năng lượng dự phòng.
Luyện kim & xử lý bề mặt kim loại
Trong ngành luyện kim, H₂SO₄ là chất tẩy gỉ hiệu quả giúp làm sạch bề mặt kim loại trước khi mạ kẽm, xi mạ, sơn phủ.Vai trò của H₂SO₄ trong luyện kim:
- Tẩy gỉ sắt thép: Loại bỏ lớp oxit sắt (gỉ sét) trên bề mặt kim loại.
- Chuẩn bị bề mặt cho quá trình mạ kẽm, nhôm, đồng, giúp tăng độ bám dính.
- Làm sạch thiết bị, đường ống trong công nghiệp chế tạo và gia công cơ khí.
Lợi ích: Sử dụng H₂SO₄ giúp kim loại sáng bóng, bền hơn, giảm hư hỏng trong quá trình gia công.
Xử lý nước thải công nghiệp
H₂SO₄ đóng vai trò quan trọng trong quá trình điều chỉnh pH nước thải, giúp loại bỏ các hợp chất độc hại trước khi thải ra môi trường.
Ứng dụng của H₂SO₄ trong xử lý nước thải:
- Trung hòa nước thải có tính kiềm, giảm độ pH để nước đạt tiêu chuẩn an toàn.
- Loại bỏ kim loại nặng (Cu, Pb, Zn) thông qua phản ứng kết tủa.
- Phá vỡ hợp chất hữu cơ độc hại, giúp nước thải an toàn hơn trước khi xả ra môi trường.
Ảnh hưởng tích cực: Giảm thiểu tác động môi trường, bảo vệ nguồn nước sạch, tuân thủ quy chuẩn môi trường nghiêm ngặt.

Sản xuất hóa chất khác
H₂SO₄ là nguyên liệu đầu vào trong sản xuất nhiều hóa chất quan trọng khác, được ứng dụng trong ngành dược phẩm, hóa mỹ phẩm, chế biến thực phẩm và công nghiệp tổng hợp.
Hóa chất được sản xuất từ H₂SO₄:
- Axit nitric (HNO₃) – sản xuất phân bón amoni nitrat, chất nổ.
- Axit clohydric (HCl) – xử lý nước, chế biến thực phẩm.
- Sulfat kim loại – sản xuất nhôm sulfat, đồng sulfat, kẽm sulfat dùng trong ngành dệt, giấy, xử lý nước.
Vai trò trong ngành công nghiệp hóa chất: H₂SO₄ là “hóa chất nền tảng”, tham gia vào hầu hết các quy trình sản xuất hóa học quan trọng.
Hướng Dẫn Lưu Trữ & An Toàn Khi Sử Dụng H₂SO₄
H₂SO₄ là một axit cực mạnh với tính ăn mòn và tính háo nước cao. Do đó, việc lưu trữ và sử dụng phải tuân thủ quy tắc an toàn nghiêm ngặt để tránh nguy hiểm cho con người và môi trường.
- Cách bảo quản H₂SO₄ an toàn
- Dùng vật liệu chống ăn mòn: Bảo quản trong bồn composite, thùng nhựa HDPE hoặc bể chứa lót cao su.
- Tránh tiếp xúc với nước và môi trường ẩm: Axit sulfuric có tính háo nước mạnh, khi pha loãng có thể sinh nhiệt lớn, gây nguy hiểm nếu tiếp xúc với da.
- Bảo quản nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp và nhiệt độ cao.
- Không để gần chất dễ cháy, kim loại phản ứng mạnh như nhôm, magie vì có thể gây cháy hoặc phản ứng nguy hiểm.
- Dán nhãn cảnh báo rõ ràng, tránh nhầm lẫn với các hóa chất khác.
- Hướng dẫn an toàn khi sử dụng H₂SO₄
- Sử dụng thiết bị bảo hộ đầy đủ:Găng tay cao su chịu axit, kính bảo hộ, mặt nạ chống hóa chất, quần áo bảo hộ.
- Sử dụng hệ thống thông gió tốt để giảm nguy cơ hít phải hơi axit.
- Lưu ý khi tiếp xúc với H₂SO₄
- Không hít phải hơi axit: H₂SO₄ có thể gây kích ứng đường hô hấp, tổn thương phổi nếu tiếp xúc lâu dài.
- Không đổ axit vào nước nhanh chóng: Luôn rót từ từ axit vào nước, không làm ngược lại để tránh phản ứng tỏa nhiệt mạnh gây nguy hiểm.
- Xử lý khi bị dính H₂SO₄ vào cơ thể:
- Dính vào da: Rửa ngay bằng nước sạch ít nhất 15 phút, sau đó bôi kem trung hòa (như dung dịch NaHCO₃ loãng).
- Dính vào mắt: Rửa ngay bằng nước muối sinh lý hoặc nước sạch liên tục trong 15 phút, sau đó đến ngay cơ sở y tế.
- Hít phải hơi axit: Di chuyển ngay đến nơi có không khí trong lành, nếu có triệu chứng khó thở, cần đưa đi cấp cứu ngay lập tức.
Vì Sao Nên Mua H₂SO₄ Tại Hóa Chất Lộc Thiên?
Hóa chất Lộc Thiên tự hào là đơn vị cung cấp axit sulfuric uy tín với các cam kết:
- Chất lượng đảm bảo – Nhập khẩu chính hãng, đầy đủ COA/MSDS chứng nhận chất lượng và an toàn.
- Giá cả cạnh tranh – Chiết khấu tốt cho doanh nghiệp, hỗ trợ hợp đồng dài hạn.
- Giao hàng nhanh chóng – Hệ thống kho tại TP.HCM, Bình Dương, Đồng Nai, vận chuyển tận nơi an toàn.
- Tư vấn kỹ thuật miễn phí – Đội ngũ chuyên gia hướng dẫn sử dụng, bảo quản an toàn, đảm bảo tối ưu hiệu suất.
- Liên hệ ngay để nhận báo giá H₂SO₄ tốt nhất!
- Hotline: 0979 89 19 29
- Địa chỉ: 452/6B Tỉnh Lộ 10, P. Bình Trị Đông, Q. Bình Tân, TP.HCM

Axit sulfuric có gây hại đến môi trường không? Nếu có, làm thế nào để xử lý an toàn?
Axit sulfuric (H₂SO₄) có thể gây ô nhiễm môi trường nếu không được xử lý đúng cách. Khi bị rò rỉ ra môi trường, nó có thể làm giảm độ pH của đất và nước, ảnh hưởng đến hệ sinh thái và sinh vật sống. Để xử lý an toàn:
Trung hòa axit bằng dung dịch kiềm như natri bicacbonat (NaHCO₃) hoặc canxi hydroxit (Ca(OH)₂) trước khi xả thải.
Sử dụng bể chứa chuyên dụng với lớp lót chống ăn mòn để lưu trữ an toàn.
Không đổ trực tiếp vào nguồn nước vì có thể gây tác động nghiêm trọng đến hệ sinh thái.
Xử lý theo quy định môi trường để tránh vi phạm pháp luật và bảo vệ môi trường sống.
Làm thế nào để phân biệt axit sulfuric giả hoặc kém chất lượng?
Axit sulfuric kém chất lượng có thể chứa tạp chất hoặc không đạt nồng độ tiêu chuẩn, ảnh hưởng đến hiệu quả sử dụng trong công nghiệp. Cách kiểm tra:
Quan sát màu sắc: H₂SO₄ chất lượng cao thường trong suốt hoặc có màu vàng nhạt, nếu có cặn lắng hoặc màu đậm bất thường, có thể chứa tạp chất.
Kiểm tra nồng độ: Sử dụng máy đo nồng độ axit hoặc khúc xạ kế để đảm bảo H₂SO₄ đạt chuẩn (thường là 98% đối với axit đậm đặc).
Kiểm tra độ ăn mòn: H₂SO₄ nguyên chất có tính ăn mòn cao, nếu phản ứng yếu với kim loại (như kẽm, nhôm), có thể đã bị pha loãng.
Yêu cầu COA/MSDS: Khi mua hàng, luôn yêu cầu giấy chứng nhận chất lượng (COA) và bảng dữ liệu an toàn hóa chất (MSDS) từ nhà cung cấp uy tín.
Axit sulfuric có bị phân hủy theo thời gian không? Nếu có, làm thế nào để bảo quản lâu dài?
H₂SO₄ là một axit ổn định và không phân hủy dễ dàng theo thời gian nếu được bảo quản đúng cách. Tuy nhiên, một số yếu tố có thể làm giảm chất lượng axit, như:
Hấp thụ nước từ không khí: H₂SO₄ có tính háo nước mạnh, nếu không đậy kín, nó sẽ hấp thụ hơi nước, làm loãng nồng độ.
Phản ứng với tạp chất: Khi tiếp xúc với kim loại hoặc các chất hữu cơ, axit có thể bị biến đổi hoặc hình thành sản phẩm phụ.
Cách bảo quản tốt nhất: Dùng thùng nhựa HDPE, bồn composite hoặc bể chứa có lớp lót cao su chống ăn mòn.
Đậy kín để tránh hấp thụ hơi nước và tránh ánh nắng trực tiếp.
Bảo quản ở nhiệt độ phòng, tránh nhiệt độ quá cao hoặc quá thấp để duy trì tính chất hóa học ổn định.
Có thể thay thế axit sulfuric bằng hóa chất nào trong một số ứng dụng công nghiệp?
Tùy vào ứng dụng, có thể thay thế H₂SO₄ bằng một số hóa chất khác, tuy nhiên không phải lúc nào cũng có sự thay thế hoàn hảo:
Trong sản xuất phân bón: Có thể dùng axit phosphoric (H₃PO₄) thay thế trong một số quy trình nhưng hiệu suất không cao bằng H₂SO₄.
Trong tẩy gỉ kim loại: Axit clohydric (HCl) có thể thay thế nhưng dễ bay hơi hơn và có mùi khó chịu.
Trong xử lý nước thải: Axit nitric (HNO₃) có thể được sử dụng trong một số trường hợp nhưng chi phí cao hơn.
Trong chế tạo pin: Không có chất thay thế trực tiếp vì H₂SO₄ đóng vai trò quan trọng trong ắc quy axit-chì.
Kết luận: Việc thay thế axit sulfuric phải xem xét kỹ lưỡng về hiệu suất, chi phí và tác động môi trường.
Tại sao không nên rót nước vào axit sulfuric mà phải làm ngược lại?
Việc rót nước vào axit sulfuric là vô cùng nguy hiểm vì phản ứng này sinh nhiệt rất mạnh, có thể gây bắn axit ra ngoài và gây bỏng nghiêm trọng. Nguyên nhân:
Tính háo nước cao: H₂SO₄ có xu hướng hút nước nhanh chóng, tạo ra nhiệt độ cao ngay lập tức.
Phản ứng tỏa nhiệt mạnh: Nếu đổ nước vào axit, hơi nước có thể bốc lên đột ngột, làm bắn axit ra xung quanh.
Cách pha loãng đúng: Chuẩn bị một thùng chứa đủ lớn để chịu được nhiệt sinh ra.
Rót từ từ axit vào nước, khuấy nhẹ để nhiệt phân tán dần.
Không đổ axit quá nhanh, tránh sinh nhiệt đột ngột.
Ghi nhớ: Luôn rót axit vào nước, không làm ngược lại để đảm bảo an toàn tuyệt đối.





